Aminas
A minas são uma classe de compostos químicos orgânicos nitrogenados derivados do amoníaco (NH3) e que resultam da substituição parcial ou total dos hidrogênios da molécula por grupos hidrocarbónicos (radicais alquilo ou arilo – frequentemente abreviados pela letra R). Se substituirmos um, dois ou três átomos de hidrogénio, teremos, respectivamente, aminas primárias (R-NH2), secundárias(R1R2NH) ou terciárias (R1R2R3N).
As aminas podem ser classificadas como simples (quando os grupos alquil são iguais) ou mistas (se estes forem diferentes).
Quando se usa os prefixos di e tri, indica-se que a amina é secundária ou terciária, respectivamente, e com grupos radicais iguais. Quando os grupos são diferentes, estes são nomeados sucessivamente, do menor para o maior, terminando o nome do composto com o sufixo “amina”. Algumas vezes indica-se o prefixo amino, indicando, de seguida a posição e o nome do grupo hidrocarbónico.
Propriedades
A presença de um par de elétrons livres é responsável por propriedades físicas e químicas particulares nas aminas.Geometria
Tais como a molécula NH3, da qual são derivadas formalmente, têm uma estrutura piramidal com 3 ligações sp3 e um par de electrões desemparelhados. Por isso, os orbitais apresentam hibridação sp3 e estão dirigidos em direção aos vértices de um tetraedro. O átomo de nitrogênio localiza-se no centro do tetraedro; as ligações covalentes (com hidrogénio ou com o radical) formarão os vértices da base, a que se oporão os dois electrões desemparelhados no vértice do topo do tetraedro.Ponto de fusão e ponto de ebulição
Como o azoto (nitrogênio) é menos electronegativo que o oxigénio, as ligações N-H apresentam-se menos polares que as ligações O-H (presentes nos álcoois). Por essa razão, as aminas formam ligações de hidrogénio mais débeis que os álcoois com pesos moleculares semelhantes. Como as ligações são mais fracas, compreende-se que os pontos de ebulição das diversas aminas também sejam mais baixos (necessitarão de menos energia para evaporar, porque também estão menos ligadas umas às outras).
Assim, as aminas primárias e secundárias têm pontos de ebulição menores que os dos álcoois, mas maiores que os dos éteres de peso molecular semelhante. As aminas terciárias, sem ligações de hidrogénio, têm pontos de ebulição mais baixos que os das aminas primárias e secundárias de pesos moleculares semelhantes.
Como bases
Como a amônia, as aminas agem como bases razoavelmente fracas (veja a tabela com exemplos de valores de força de ácidos conjugados Ka). O átomo de nitrogênio possui um par de electrões livres que pode receber um ião (íon) H+ para formar um ião amônio substituído
| Íons do composto | Ka (força do ácido conjugado) |
|---|---|
| Anilina C6H5-NH2 | 2.0·10−5 M |
| Amônia NH3 | 5.6·10−10 M |
| Etilenodiamina NH2-CH2-CH2-NH2 | 1.3·10−10 M |
| Butilamina CH3-CH2-CH2-CH2-NH2 | 0.15·10−10 M |
Solubilidade
Os pares de pontos sobre os átomos N nas reações químicas mostradas neste artigo representam o par de electrões livres do nitrogêniodas aminas. Estes pares também contribuem para a solubilidade de aminas simples mediante a formação de ligações de hidrogênio com moléculas de água.
Reações
Um alcano pode reagir com uma amina para formar uma amina alquil-substituída correspondente, com liberaçãode um ácido de halogênio: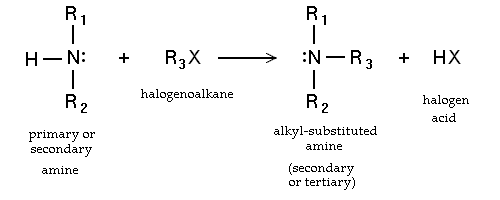
Se a amina reagente é uma amina terciária neste tipo de reação, formam-se um cátion de amônio quaternário e um ânion (ou "anião") haleto:
Os compostos com íons emparelhados desta forma são chamados de sais quaternários de amônio. O "X" mostrado nas reações anteriores pode também ser outro tipo de grupo abandonador.
Exemplos de aminas
Os aminoácidos contêm um grupo amino e um grupo carboxilo ligados ao mesmo átomo de carbono. Os aminoácidos unem-se uns aos outros através da ligação destes dois grupos – que formam um grupo amida – dando origem às ligações peptídicas que estruturam asproteínas.
A degradação de proteínas (por exemplo, quando um pedaço de carne apodrece), leva, pelo contrário, à sua decomposição em aminas distintas. Os odores mais desagradáveis de que geralmente nos lembramos são, provavelmente, devidos à presença de aminas. Por exemplo, a 1,5-pentanodiamina (mais conhecida pelo sugestivo nome de cadaverina, libertada pelos corpos em putrefacção, o escatol, umcomposto heterocíclico presente nos excrementos, a 1,4-butanodiamina (putrescina – outro cheiro “a podre”), etc…
Os alcalóides são compostos complexos presentes na constituição das plantas que contêm grupos amina. Podemos citar alguns exemplos mais conhecidos, como a morfina, anicotina, etc.
A importância das aminas, em termos biológicos, é inegável. A classe de compostos designados por β-feniletilaminas inclui a adrenalina, a noradrenalina, a mescalina, etc. Assulfamidas, que afetam as bactérias ao inibir nelas a produção de ácido fólico, mas que são inócuas para o ser humano, contêm um grupo amino. O neurotransmissor GABA (ácido 4-aminobutanóico) também contém um grupo amino. Alguns derivados do ácido p-aminobenzóico são também usados como anestésicos.
Encontram-se aminas secundárias em alguns alimentos (carne e peixe) ou no fumo do tabaco. Estas podem reagir com os nitritos (presentes nos conservantes utilizados nos produtos alimentares e usados como fertilizante, no caso das plantas, como o tabaco), levando à formação de N-nitrosoaminas secundárias, que são cancerígenas.
Referências
- Robert T. Morrison, Robert N. Boyd, and Robert K. Boyd, Organic Chemistry, 6th edition (Benjamin Cummings, 1992, ISBN 0-13-643669-2
Não há dúvidas quanto à presença marcante da química em todos os nossos dias, em todas as nossas ações. Quando pensamos, cozinhamos, corremos, ou tomamos um comprimido para a dor de cabeça, acionamos em nosso organismo uma série coordenada de reações bioquímicas. Quando tomamos banho, preparamos o café ou lavamos a louça, utilizamos um amplo conjunto de eventos físico-químicos.
Para que tenhamos consciência da presença dessa classe de substâncias na vida – e na morte – das pessoas, e na história da humanidade, basta que pensemos em alguns exemplos, como os que são abordados a seguir.
Aminas produzidas por plantas e animais apresentam as mais diversas propriedades fisiológicas. As histaminas fazem parte de um grupo de substâncias denominadas aminas bioativas. Sob condições fisiológicas normais os músculos contêm as poliaminas espermina e espermidina, que atuam como hormônio ou fator de crescimento, sendo essenciais para as células. A adrenalina é liberada pelas glândulas supra-renais, quando sentimos forte medo ou excitação. A noradrenalina e a mescalina pertencem à mesma classe de compostos da adrenalina.
Os aminoácidos que compõem as proteínas são unidos por ligações peptídicas, e quando, por exemplo, um pedaço de carne sofre decomposição por bactérias, há formação de putrescina e a cadaverina, as aminas responsáveis pelo mau cheiro. A metilamina, a dimetilamina e a trimetilamina são responsáveis pelo odor dos peixes.
As vitaminas são co-fatores de proteínas de grande importância no funcionamento do organismo. O nome foi estabelecido em 1911, quando o químico polonês Casimir Funk descobriu na casca do arroz um "fator anti-beriberi" (vitamina B6 ou niacinamida), capaz de prevenir e curar a doença experimentalmente em animais e seres humanos. Como a substância era uma amina, Funk a denominou de "vital amin" (ou amina vital), abreviado para "vitamina".
Na execução de Sócrates, em aproximadamente 400 a.C., o filósofo grego foi forçado a tomar um extrato de Conium maculatum. O principal composto deste extrato é a coniina, uma substância extremamente tóxica.
Os curares eram drogas obtidas de diversas plantas dos gêneros Strychnos eChondodendron americanas e africanas, utilizadas pelos índios para produzir flechas envenenadas para caça e pesca. Os extratos de curares agem como bloqueadores neuromusculares, sendo capazes de causar morte por asfixia mesmo em animais de grande porte.
Várias sulfonamidas, ou simplesmente sulfas, são utilizadas como medicamento antibacteriano, pois inibem a síntese de ácido fólico em bactérias.
A nicotina é um alcalóide encontrado em grande quantidade (4-6%) em folhas de fumo,Nicotiana tabacum, utilizada no século XVII como o primeiro inseticida orgânico. A cocaína, presente na folha de coca, Erythroxylon coca, foi isolada pela primeira vez em 1860. Em 1886, o farmacêutico americano Dr. John Pemberton começou a comercializar uma bebida preparada com extrato de Cola acuminata e Erythroxylon coca. Por sugestão, a bebida, inicialmente chamada de “French Wine Coca”, passou a ser denominada coca-cola. A utilização de extrato de E. coca foi proibida, em função da presença da cocaína. Apesar de ser considerada uma droga de uso ilícito, a cocaína foi o primeiro composto a ser utilizado como anestésico local para cirurgia de olhos e extração de dentes.
O ópio, preparado dos bulbos de Papaver somniferum, é conhecido há séculos por suas propriedades soporíferas (que causam sonolência) e analgésicas. Em 1804, na França, Armand Séquin isolou o seu constituinte principal, a morfina.
Sais de amônio quaternário são surfactantes catiônicos bastante usados nas formulações de sabões, detergentes, shampoos e amaciantes. Na composição de amaciantes, sais de amônio quaternário contendo duas cadeias carbônicas longas e duas menores são normalmente utilizados. Esses compostos atuam ligando-se por atração eletrostática à superfície da fibra, e formam um filme extremamente fino. As cadeias longas atuam como lubrificantes conferindo maior flexibilidade e maciez ao tecido.
Assim, embora a química orgânica geralmente não nos seja apresentada, diariamente, sob forma de teoria, na prática estamos imersos em um grande globo de reações bio-físico-químicas, que, de forma coordenada e regulada, permitem o funcionamento das células, órgãos e organismos. Também utilizamos e controlamos essas reações nos processos industriais, na preparação de cosméticos e alimentos. Além do mais, são esses simples eventos que compõem todo o ambiente à nossa volta, com seus cheiros, texturas e cores.
Dentre os vários compostos que a química orgânica nos apresenta, cujo número já ultrapassa os 11 milhões, devemos conhecer a grande classe de substâncias representadas pelas aminas. Antes, porém, de investigarmos sua atuação em nosso dia-a-dia, devemos nos lembrar que, estruturalmente, as aminas são compostos que possuem um, dois ou três grupos orgânicos ligados a um átomo de nitrogênio. De acordo com os ligantes presentes, temos as aminas classificadas como alifáticas, aromáticas, e as reações responsáveis pela formação de amidas, sulfonamidas, sais de amônio e outros vários compostos nitrogenados. As propriedades químicas das aminas são devidas, principalmente, à presença do par de elétrons não-ligantes no átomo de nitrogênio.
N°: 5,38
Professor(a): Miramar
Turma: 3° "A"










Nenhum comentário:
Postar um comentário